La FDA acaba de aceptar múltiples análisis de sangre de 15 minutos para detectar coronavirus, pero hay advertencias
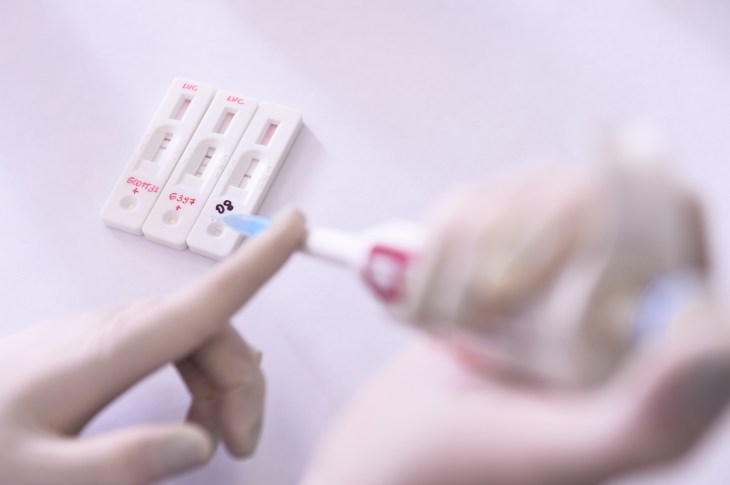
El jueves, la FDA modificó su política de emergencia en torno a las pruebas diagnósticas para SARS-CoV-2, el nuevo coronavirus que causa COVID-19. Después de un cambio realizado el 16 de marzo, la agencia abrió la puerta para que una serie de entidades privadas y laboratorios específicos desarrollaran y distribuyera pruebas que pueden proporcionar resultados en el acto en tan solo 15 minutos, pero hay algunas advertencias bastante grandes a tener en cuenta a medida que escuchas sobre más de estos que llegan al mercado.
Las pruebas, que son “serológicas”, lo que significa que identifican la presencia de anticuerpos en la sangre de una persona, difieren considerablemente de las pruebas moleculares que se utilizan actualmente bajo la Autorización de Uso de Emergencia (EUA) por laboratorios aprobados por la FDA y sitios de pruebas. Las pruebas serológicas muestran que una persona ha desarrollado anticuerpos contra el SARS-CoV-2, lo que significa que muy probablemente entró en contacto con él (y lo tienen, o ya se han recuperado de tenerlo). Las pruebas moleculares realmente detectan la presencia de ADN viral en el torrente sanguíneo, que es un indicador mucho más definitivo de que actualmente tienen una infección activa (al menos en el momento en que se tomó el hisopo).
Las pruebas serológicas todavía se han utilizado ampliamente en países donde se ha demostrado que la respuesta a la pandemia COVID-19 es eficaz, incluso en China, Taiwán y Singapur. También se han utilizado en diferentes comunidades en los EE.UU., sobre la base de directrices anteriores en torno al diagnóstico de laboratorio privado. Pero el 26 de marzo, la FDA nombró a 29 entidades que proporcionaron notificación a la agencia según sea necesario y ahora son capaces de distribuir sus pruebas.
Es importante tener en cuenta que estas pruebas no han sido revisadas o validadas por la FDA, a diferencia de las pruebas moleculares que se incluyen en la categoría de uso de emergencia de la organización. En su lugar, la FDA “no tiene la intención de oponerse al desarrollo y distribución por los fabricantes comerciales” de estas pruebas, siempre que cumplan una serie de criterios, incluyendo la calificación de los resultados de sus resultados de prueba reportados con la siguiente información:
- Esta prueba no ha sido revisada por la FDA.
- Los resultados negativos no descartan la infección por SARS-CoV-2, particularmente en aquellos que han estado en contacto con el virus. Se deben considerar pruebas de seguimiento con un diagnóstico molecular para descartar la infección en estos individuos.
- Los resultados de las pruebas de anticuerpos no deben utilizarse como única base para diagnosticar o excluir la infección por SARS-CoV-2 ni para informar sobre el estado de la infección.
- Los resultados positivos pueden deberse a una infección pasada o presente con cepas coronavirus no SARS-CoV-2, como coronavirus HKU1, NL63, OC43 o 229E.
La FDA señala específicamente en sus preguntas frecuentes sobre uso de emergencia que estas entidades han informado de su propia validación de estas pruebas, y que no buscarán la autorización de uso de emergencia. Dicho esto, ahora no hay nada que impida que las entidades de esta lista distribuyan sus pruebas, lo que significa que serán capaces de ser utilizadas en la prueba de los estadounidenses y la pintura de una imagen más amplia de la posible propagación del coronavirus novedoso, con la advertencia señalada anteriormente que la FDA no considera estas pruebas utilizadas solo para ser confirmación positiva de un caso definitivo SARS-CoV-2, o por el contrario, un seguro de que alguien no tiene el virus.
Sin embargo, a falta de mejores opciones como la ampliadisponibilidad de las pruebas que se aprueban bajo el EUA, estas pruebas serológicas (muchas de las cuales pueden proporcionar resultados in situ con sólo un pinchazo de sangre) serán útiles para pintar una imagen más precisa de la propagación general y alcance del coronavirus, especialmente para clínicas más pequeñas, clínicas de GP y laboratorios locales que no tienen acceso prioritario al equipo y suministros necesarios para los esfuerzos de pruebas moleculares.
Por ejemplo, una prueba en esta lista, el dispositivo de prueba rápida Healgen Scientific COVID-19 IgG/IgM (Whole Blood/Serum/Plasma), no requiere instrumentación y puede proporcionar resultados en solo 15 minutos. Distribuidor Ideal Rehab Care está trabajando con su representación legal Fox Rothschild para comenzar a importar las pruebas de Singapur para su uso “tan pronto como sea posible.”
La FDA actualizando su sitio web con Healgen como una de las entidades que le han notificado de la intención de utilizar su prueba serológica es lo que desbloqueó la capacidad para que la empresa comenzar a distribuir: Todavía es ilegal que cualquier persona que no esté en esta lista lo haga , y la FDA todavía también prohíbe específicamente el uso de pruebas serológicas en el hogar en sus directrices oficiales.
Contact Information:
Keywords: afds, afdsafds










